식품의약품안전처 산하 식품의약품안전평가원이 심혈관 환자의 치료 효과·편의성 향상을 위한 혁신 기술이 적용된 심혈관용 의료기기와 의약품-의료기기 융복합 제품의 허가·심사 가이드라인을 제·개정했다고 29일 밝혔다.
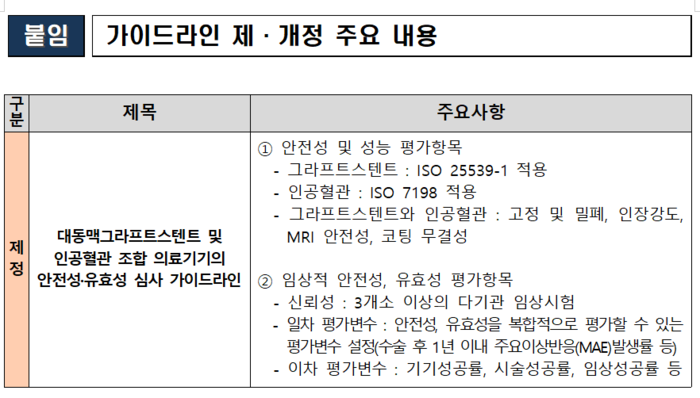
이번 가이드라인은 최근 심근경색증 등 심혈관 환자 수가 증가하고, 풍선확장식 관상동맥 성형술용 카테터, 약물방출스텐트 등 심혈관 질환에 사용되는 의료기기와 융복합 제품이 많이 허가되고 있어 신속한 허가를 돕기 위해 마련했다. 제품 안전성·성능평가 방법, 임상적 안전성·유효성 평가변수 등을 담아 대동맥그라프트스텐트 같은 제품의 선제적 심사 방안을 제시한다.
의약품이 포함된 심혈관 제품의 심사 신청 증가에 따라 혈관용스텐트와 풍선확장식혈관성형술용카테터의 의약품 분야 기술문서 작성법, 의약품 관련 세부자료 요건 등을 담은 가이드라인도 개정했다.
식약처 관계자는 “이번 가이드라인 제·개정으로 국내 업계 혁신적인 제품 개발을 촉진하고 융복합 제품 개발 업체의 의약품 관련 심사의 어려움이 해소될 것”이라면서 “앞으로도 심혈관용 의료기기가 국민에게 안전하고 신속하게 공급되도록 전문성과 규제과학을 기반으로 산업계 지원을 지속하겠다”고 말했다.
송윤섭 기자 sys@etnews.com









